Stabilité des gaz nobles
Les gaz nobles sont des gaz monoatomiques qu'on a mis très longtemps à découvrir car ils sont inertes (ne réagissent pas avec d'autres composés).
La raison est qu'ils ont leur couche de valence saturée, ce qui leur donne une très grande stabilité.
Tous les autres atomes chercheront donc à atteindre cette stabilité en obtenant une couche de valence pleine.

Les ions monoatomiques
Une façon pour un atome d'obtenir une couche de valence pleine est de gagner ou perdre un ou plusieurs électrons : il devient alors un ion.

Un électron porte une charge négative, donc si un atome perd un électron il devient chargé positivement.
Attention, un atome ne peut pas perdre ou gagner plus de 3 électrons.
Exemples :
- Na+ est un atome Na qui a perdu 1 électron
- Ca2+ est un atome Ca qui a perdu 2 électrons
- F- est un atome F qui a gagné 1 électron

Remarque 1 :
Les éléments chimiques de la première colonne du tableau périodique donneront les ions X+ (H+, Li+, Na+...), ceux de la deuxième colonne les ions X2+ (Be2, Mg2+...). Ceux de la dernière colonne donneront les ions X- (F-, Cl-...).
Remarque 2 :
Les ions sont des espèces chimiques qui se retrouvent dans les solutions. Or une solution étant toujours électriquement neutre, la solution sera constituée d'ions positifs (cations) et d'ions négatifs (anions) dont les charges se compenseront.
Exemples :
- Nom : Chlorure de sodium
- Formule de la solution : (Na+ ; Cl-)
- Formule du solide : NaCl
- Nom : Chlorure de calcium
- Formule de la solution : (Ca2+ ; 2 Cl-)
- Formule du solide : CaCl2
Les molécules
Formation des molécules
Dans une molécule, les atomes échangent des électrons de façon à remplir leur dernière couche. Chaque atome va placer un ou plusieurs électrons dans la couche électronique de son atome voisin, formant ainsi une liaison covalente.
Exemple : Formation du dihydrogène H2
- Chaque atome H place un électron dans la couche de valence de son voisin.
- Ces deux électrons "partagés" vont former une liaison covalente H - H.
- Chaque atome H a maintenant une une couche de valence pleine 1 s2

Exemple : Formation de l'eau H2O
- L'atome O place un électron dans la couche de valence de chaque H voisin.
- Deux liaisons O - H sont ainsi créées.
- Chaque atome H a maintenant une couche de valence pleine 1 s2
- L'atome O a maintenant une couche de valence pleine 2 s2 2 p6
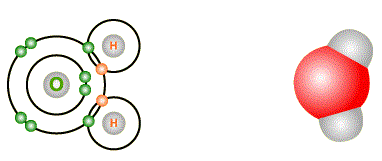
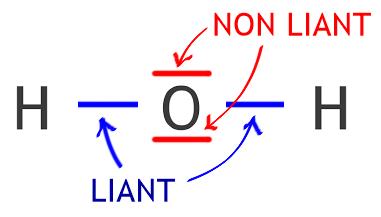
Représentation de LEWIS
La représentation de LEWIS permet de visualiser la répartition des électrons de la couche de valence :
- Doublet liant : matérialise la liaison entre deux atomes (partage d'électrons)
- Doublet non liant : les électrons qui ne participent pas aux liaisons se regroupent par paire.