Toute la matière présente dans l'Univers est constituée d'éléments chimiques créés au cœur des étoiles. Ces éléments peuvent se retrouver dans des atomes, des molécules, des ions...
On veut dans cette première partie déterminer la composition d'un atome.
Abondance des atomes
On est capable aujourd'hui de déterminer la proportion de chaque atome présent dans un ensemble déterminé.
Ci-contre sont données les proportions en masse des atomes présents dans l'Univers et dans l'être humain.
Questions :
- Quels sont les éléments les plus présents dans l'Univers ?
- Quelle masse d'oxygène constitue une personne de 70kg ?

1. Les deux éléments les plus abondants dans l'Univers sont l'hydrogène et l'hélium.
2. Le corps humain est constitué de 65% en masse d'atomes d'oxygène (essentiellement dans les molécules d'eau). Un personne de 70kg en contient donc m=70x0,65=45,5 kg
Composition d'un atome
Dans cette simulation tu peux :
- "Construire" un atome en ajoutant des protons, neutrons et électrons tout en voyant l'impact sur sa position dans le tableau périodique mais aussi en voyant l'impact sur la charge globale (n'oublies pas qu'un atome est toujours électriquement neutre) et sur son nombre de masse.
- Voir le lien entre le symbole de l'atome (son écriture) et a constitution.
- Tester tes connaissances sur le chapitre dans différents jeux
Les constituants de l'atome d'oxygène, dont l'écriture symbolique se trouve ci-dessous, sont représenté sur le schéma ci-contre :

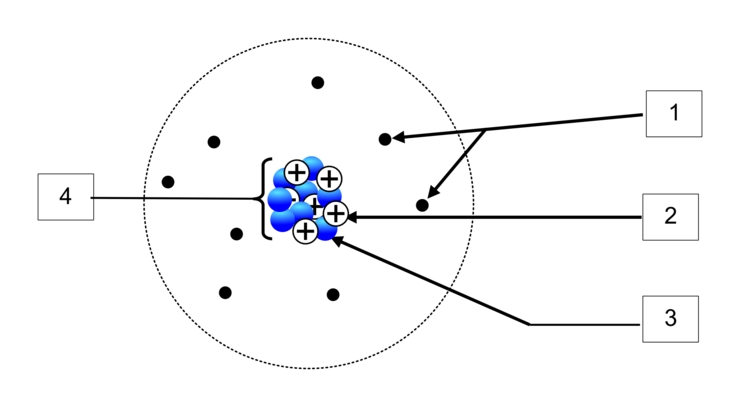
Questions :
- Indiquer ce que représentent les éléments 1, 2, 3 et 4 sur le schéma.
- Donner la composition de l'atome d'oxygène
- L'hélium porte deux charges positives et deux neutrons. Donner sa représentation.
1. Les différents éléments sont :
- Electrons
- Protons
- Neutrons
- Noyau (constitué de nucléons que sont les protons et neutrons)
2. L'atome d'oxygène est constitué de 8 protons et (16-8)=8 neutrons
3. Z=2 et A=4 donc \large {_2^4He}
Taille et masse d'un atome
On s'intéresse ici aux atomes de carbone constituant un morceau de graphène. Le graphène est un matériau constitué d'un seul plan d'atomes de carbones, d'une épaisseur d'un dixième de nanomètre.
L'image ci-contre est une "image" d'un morceau de graphène obtenue grâce à un microscope à effet tunnel. La longueur L mesure 6 cm une fois le document imprimé.
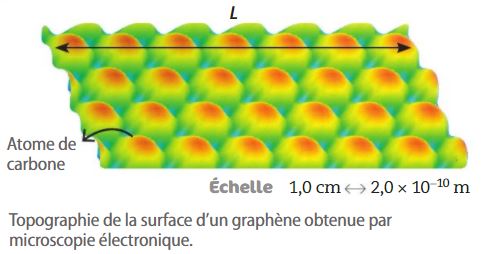
Données :
Masse des nucléons : m_{nucléon}=1,67.10^{-27} kg
Masse des électrons : m_{électron}=9,11.10^{-31} kg
Questions :
- Déterminer le diamètre d'un atome de carbone.
- Comparer le diamètre de l'atome au diamètre de son noyau dont l'ordre de grandeur est 10–15 m.
- Pourquoi dit-on que la matière est principalement constituée de vide ?
- La représentation de l'atome de carbone est {}_6^{12}C.
- Calculer la masse du noyau de l'atome de carbone.
- Calculer la masse des électrons présents dans l'atome de carbone.
- Pourquoi dit-on que la masse d'un atome est essentiellement présente dans son noyau ?
- Comment calculer la masse d'un atome à partir de son expression {}_Z^AX.
1. On peut "voir" 7 atomes de carbone côte à côte sur la distance L. Cette distance L vaut dans la réalité 6 \times 2.10^{-10}=12.10^{-10}m, ce qui représente pour un seul atome un diamètre de 12.10^{-10}/7=1,7.10^{-10}m.
2. Pour comparer les deux diamètres on en fait le rapport : r = \frac{1,7.10^{-10}}{1,0.10^{-15}}=1,7.10^5
3. On voit donc que l'atome est environ 100 000 fois plus grand que son noyau. L'atome est donc essentiellement constitué de vide. On dit qu'il a une structure lacunaire.
4. En ce qui concerne le carbone :
- Masse du noyau : m_{noyau}=12 \times 1,67.10^{-27}=2,0.10^{-26}kg
- Masse des électrons : m_{électrons}=12 \times 9,11.10^{-31}=1,1.10^{-29}kg
- Si on calcule le rapport entre ces deux masse on trouve que la masse du noyau est 1800 fois plus grande que celle des électrons. On peut donc dire que la masse de l'atome se trouve presque intégralement dans son noyau.
- La masse d'un atome peut donc se calculer en multipliant son nombre de masse A par la masse d'un nucléon.
