L'atome
Un atome est constitué d'un noyau autour duquel se déplacent un ou plusieurs électrons.
Le noyau
La masse de l'atome se concentre dans son noyau (les électrons ont une masse négligeable par rapport aux nucléons qui forment le noyau).
Le noyau de l'atome est constitué de deux types de particules appelées nucléons :
- Protons (chacun porte une charge positive)
- Neutrons (ils ne portent pas de charge)
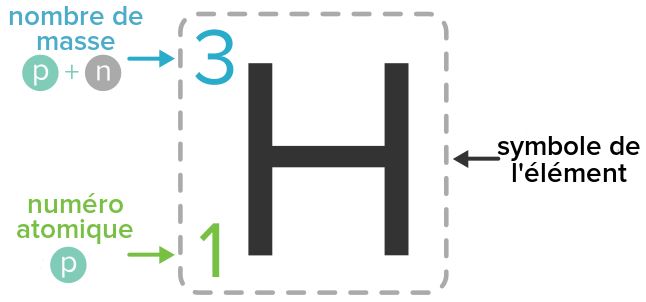
Sa composition est donnée par l'écriture conventionnelle : \Large \boxed{^A_ZX}
- A : nombre de masse qui représente le nombre de protons et de neutrons
- Z : Numéro atomique qui représente le nombre de protons
- X : Symbole de l'atome
Exemple : donner la constitution du noyau de l'atome de phosphore \Large ^{31}_{15}P.
- Nombre de protons : p = Z = 15
- Nombre de neutrons : A = n + p donc n = 31 - 15 = 16
Electrons et couches électroniques
Un atome étant électriquement neutre, il est constitué d'autant d'électrons que de protons.
Les électrons se trouvent dans une "zone" appelée nuage électronique mais ne peuvent pas se trouver n'importe où dans le nuage ; ils ne peuvent se placer que sur des niveaux électroniques bien précis appelés couches électroniques.
Chaque couche est constituée de sous-couche (s, p, ...) qui peuvent contenir un nombre maximal d'électrons (2 pour les sous-couches "s" et 6 pour les sous-couches p). Les électrons occupent en priorité les sous-couches les plus proches du noyau.
On retient donc l'ordre des sous-couches (de la plus proche à la plus éloignée du noyau) :
1s 2s 2p 3s 3p

Configuration électronique de l'atome d'oxygène
Remarque : la dernière couche occupée est appelée couche de valence.
Exemple : donner la structure électronique de l'atome de phosphore \Large ^{31}_{15}P et sa couche de valence.
L'atome de phosphore contenant 15 protons il a 15 électrons dans son nuage électronique.
Sa structure électronique est donc : \large 1s^2 \, 2s^2 \, 2p^6 \, 3s^2 \, 3p^3
Sa couche de valence contient donc 5 électrons et s'écrit : \large 3s^2 \, 3p^3
Taille de l'atome
Le rayon d'un atome (voisin de 10-10 m) est environ 100 000 fois plus grand le rayon de son noyau (voisin de 10-15 m).
On dit que l'atome a une structure lacunaire.
Exemple : comparer les rayons de l'atome de béryllium et de son noyau.
Données : r_{noyau}=2,5.10^{-15}m et \large r_{atome}=1,1.10^{-10}m
On calcule le quotient entre ces deux rayons : \frac{r_{atome}}{r_{noyau}}=\frac{1,1.10^{-10}}{2,5.10^{-15}}=0,44.10^5=44 000
L'atome de béryllium est bien lacunaire puisque son noyau est 44 000 fois plus petit que lui.
Structure électronique et tableau périodique
Tableau périodique
Le tableau périodique recense tous les éléments chimiques présents dans l'Univers.
Il est structuré en lignes (appelées aussi périodes) et colonnes.
Les éléments chimiques d'une même colonne ont des propriétés chimiques similaires.
Exemple :
- Dernière colonne : gaz rares ou inertes
- Première colonne : alcalins (réagissent fortement avec l'eau, donnent un ion porteur d'une seule charge + (Li+ ,Na+, K+...)
Lien entre tableau et structure électronique
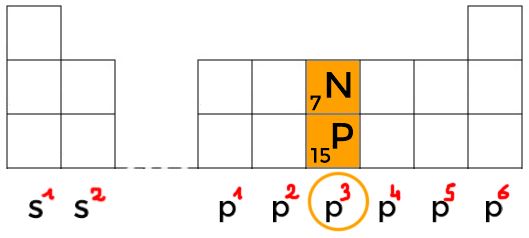
Les lignes représentent les couches.
Les sous-couches s et p sont regroupées en blocs (à gauche le bloc s et à droite le bloc p).
Dans une même ligne (appelée période) quand on va de la gauche vers la droite le nombre d'électrons dans les sous couches augmente :
\large {s^1 , s^2 , p^1, p^2 , p^3 , p^4 , p^5 , p^6}

Ainsi, les éléments ayant la même couche externe (couche de valence) se retrouvent dans la même colonne (on parle de famille).
C'est le cas de l'azote N dont la couche externe est 2s2 2p3 et le phosphore P dont la couche externe est 3s2 3p3.