Pourcentage massique
L'air est un mélange de plusieurs gaz dont les deux principaux sont le diazote (N2) et le dioxygène (O2). Si on souhaitait "créer de l'air" à partir de ces deux gaz purs il faudrait mélanger 40 g de dioxygène et 160 g de diazote pour obtenir 200 g d'air.
- Calculer le pourcentage massique de dioxygène dans l'air.
- En déduire le plus simplement possible le pourcentage massique de diazote dans l'air.
1) Pour calculer le pourcentage massique de dioxygène il faut calculer le quotient de la masse de dioxygène par la masse d'air soit :
p(O_2) = \frac{m(O_2)}{m(air)} = \frac{40}{200} = 0,20 = 20 %
2) Si on considère que seuls ces deux gaz composent l'air alors le pourcentage en diazote vaut 80 %.
Identifier un corps par changement d'état
Afin de comparer la fusion de l’eau pure, de l’eau salée et du cyclohexane (produit souvent utilisé dans l’industrie chimique), Charlotte a représenté l’évolution de la température de chacun de ces liquides en fonction du temps. Malheureusement, elle a oublié de légender son graphique.
Identifier le corps correspondant à chaque courbe ci-contre en justifiant vos réponses.

Les corps purs présentent un palier lors du changement d'état (courbes 2 et 3).
La courbe 1 est donc celle d'un mélange, c'est à dire l'eau salée.
La température du palier correspond à la température de changement d'état. Comme on sait que l'eau fond à 0°C on peut dire que la courbe 2 correspond à la fusion de l'eau pure solide.
La courbe 3 est donc celle du cyclohexane, on sait maintenant qu'il change d'état à environ 6°C (mais on ne sait pas quel est le changement d'état : fusion ou vaporisation ?).
Utiliser la masse volumique
Lors de ses vacances en Guyane une personne croit avoir trouvé une pépite d'or. Cette pépite a une masse de 15 g et un volume de 5 mL.
On connait la masse volumique de l'or : \rho(or) = 19 300 kg/m^3
- Comment déterminer la masse de la pépite ?
- Comment déterminer le volume de la pépite ?
- Cette pépite est-elle en or ?

1) La masse peut se mesurer grâce à une balance.
2) Pour mesurer le volume de la pépite on peut utiliser a méthode de déplacement d'eau en mesurant le volume d'eau déplacé si on y immerge la pépite.
3) On va donc calculer la masse volumique de notre "pépite" en faisant le quotient de sa masse par son volume puis on la comparera à celle de l'or.
ATTENTION : il faut que les unités correspondent. La masse est en grammes et la masse volumique en kg (par mètre cube).
La première solution est de convertir les kg/m3 en kg/mL (compliqué).
Une autre solution consiste à savoir qu'un mètre cube d'eau a une masse d'une tonne (soit 1000 kg). Du coup la masse volumique de l'or est 19,3 fois supérieure. Or 1 mL d'eau a une masse de 1 g donc l'or aura une masse volumique de 19,3 g/mL
On calcule alors la masse volumique de la pépite : \rho(pépite) = \frac{15}{5} = 3 g/mL. Ce n'est pas de l'or...
Réaliser une CCM
Afin de savoir ce que contient un médicament on réalise une CCM.
Dépôts effectués :
- A : Aspirine
- B : Paracétamol
- C : Médicament inconnu
- D : Caféine
- L'aspirine utilisée est-elle pure ?
- Le médicament est-il pur (constitué d'une seule espèce chimique) ?
- Que contient le médicament ?
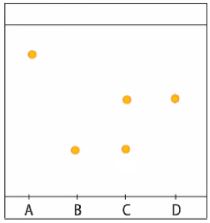
1) Il n'y a qu'une tâche, on peut donc supposer que le corps est pur mais ce n'est pas sûr (peut-être qu'une autre espèce ne se révèle pas).
2) La CCM du médicament permet de voir deux tâches. Le médicament contient donc au moins deux espèces chimiques différentes, il n'est pas pur.
3) Les deux tâches correspondent exactement aux composés B et D. Le médicament contient donc du paracétamol et de la caféine.
