Le cours en vidéo
© Florence RAFFIN
Corps pur et mélange
Définition
Un corps pur est constitué d’une seule entité chimique.
Un mélange peut être homogène si on ne distingue qu’une espèce (eau salée), hétérogène si on en distingue plusieurs (grains de sable dans de l'eau).
Pourcentage
On peut déterminer la composition d'un mélange à partir de son pourcentage (massique, volumique...).
Le pourcentage massique se calcule grâce à l'expression :
\boxed {P(A) = 100 \times \frac{m_A}{m}}

Le pourcentage massique est sans dimension !
Exemple :
Dans une barre d'acier de 200 g il y a 198 g de fer et 2 g de carbone. Le pourcentage massique de fer vaut :
P(carbone) = 100 \times \frac{m_{carbone}}{m_{acier}} = 100 \times \frac{2}{200} = 1 \%
Identifier une espèce chimique
Tests chimiques
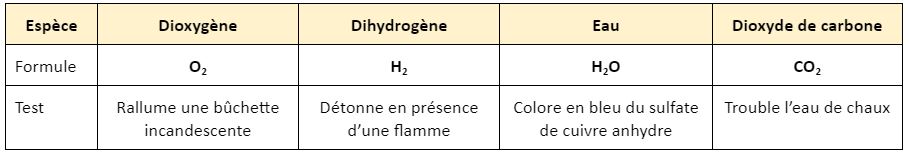
Ces tests sont des réactions chimiques qui donnent un résultat caractéristique.
Propriétés physiques
Chaque espèce chimique a des caractéristiques physiques particulières qui permettent de l'identifier
Masse volumique
La masse volumique des corps purs est connue et s'exprime en g/L (ou kg/m3).
On peut donc, en la calculant pour un échantillon donné, identifier la nature de l'échantillon.
\boxed {\rho(A) = \frac{m_A}{V_A}}

\rho en g/L
m en g
V en L
Remarques :
Les valeurs pour l’eau et l’air sont à connaître !
- Pour l’eau pure à 20°C : ρeau = 1 kg/L = 1 g/mL
- Pour l’air à 20°C à pression atmosphérique : ρair = 1,3 g/L
Un corps “flottera” dans un autre corps ayant une masse volumique plus grande.
Température de changement d'état
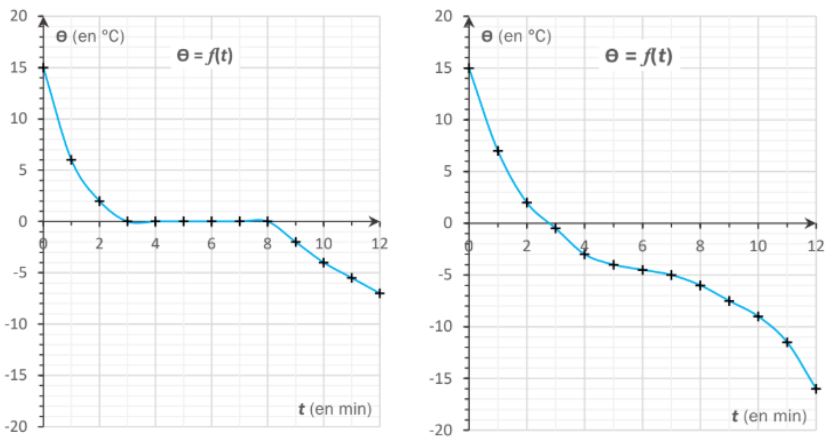
Le changement d'état d'un corps pur se fait à température constante. Observer un palier de température lors du changement d'état permet de caractériser un corps pur.
Sur la courbe de gauche on voit un palier (l'eau est pure) mais pas sur celle de droite (c'est de l'eau salée).
Cas des solides :
Les températures de changement d'état des corps purs sont connues.
Le banc Kofler est constitué d'une plaque chauffante dont la température croit régulièrement d'un bout à l'autre (de 50°C à 250°C environ). En plaçant un solide on peut voir à quelle température il fond puis la comparer à la température théorique de fusion.
Exemple : Sur la photo on mesure une température de fusion de 136°C qui permet de confirmer que la poudre est bien de l'aspirine.

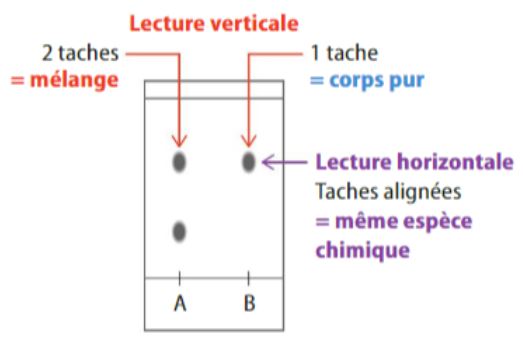
Chromatographie sur couche mince (CCM)
Cette technique permet de séparer les constituants d’un mélange et de les identifier.
L’éluant, en montant le long de la plaque, va entraîner les constituants à des vitesse différentes ce qui les sépare.
Pour un éluant donné, une espèce progressera toujours de la même façon.