Rappels de seconde

Mélange homogène et hétérogène
Différence en solubilité et miscibilité
Distinguer une molécule et un ion
Réaliser un tableau d'avancement
Cohésion des solide
Dans les solides les entités chimiques sont liées entre elles par des interactions plus ou moins fortes qui dépendent de leur nature.
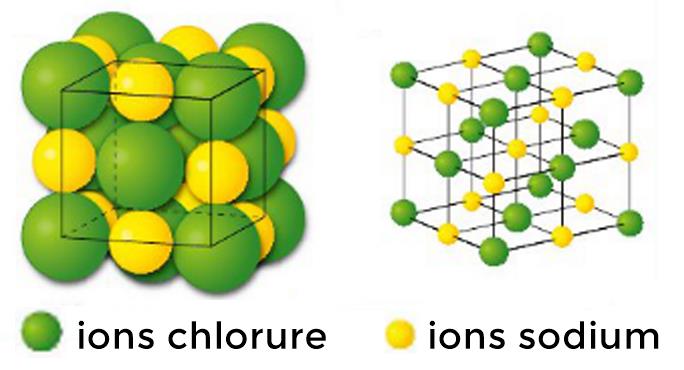
Solides ioniques
Structure régulière d'ions positifs (cations) et négatifs (anions).
La cohésion du solide est due aux interactions électrostatiques.
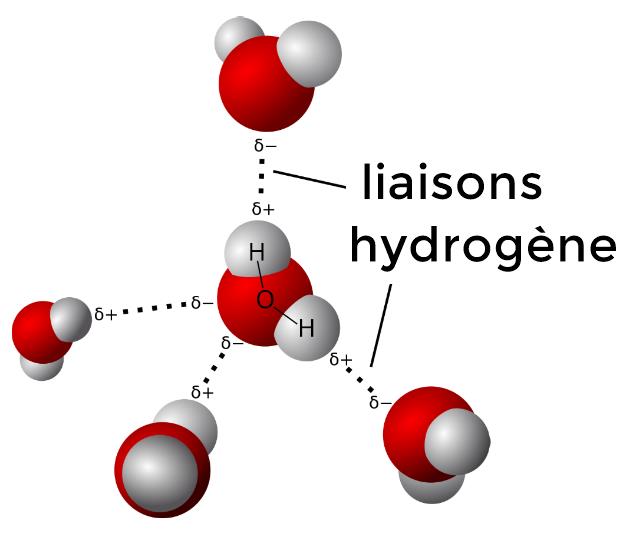
Solides moléculaires
Molécules liées par des interactions de type Van der Waals (entre les nuages électroniques des molécules) et/ou des liaisons hydrogène (entre un atome H et un atome très électronégatif).
Dissolution d'un solide ionique
Description moléculaire
Dissociation
Les molécules d’eau s’approchent du solide et fragilisent les interactions électrostatiques entre les cations et les anions
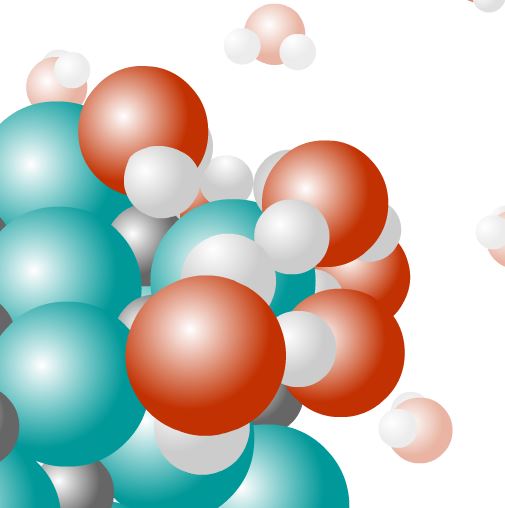
Solvatation
Les molécules d’eau entourent les ions, formant alors des sphères de solvatation rendant ces derniers moins "visibles" électrostatiquement.

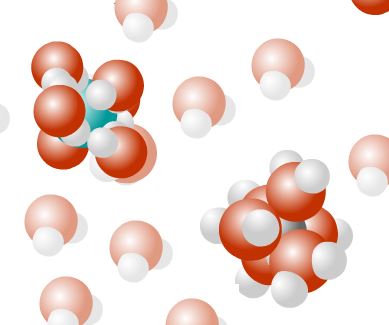
Dispersion
Les ions solvatés s’éloignent du solide et se dispersent parmi les molécules d’eau. On peut dire que les ions sont en phase aqueuse
Equation de dissolution
L'équation de dissolution doit traduire le fait que le solide se dissocie en ions en phase aqueuse.
NaCl_{(S)} \xrightarrow{H_2O} Na^+_{(aq)} + Cl^-_{(aq)}
Le solide ionique est neutre, et les ions peuvent porter plusieurs charges. Il faut donc être vigilent sur la conservation de la matière et des charges

FeCl_{2 (S)} \xrightarrow{H_2O} Fe^{2+}_{(aq)} + 2 Cl^-_{(aq)}
Dans ce cas si on dissout 1 mol de chlorure de fer dans 1L d'eau, la concentration en ions fer II sera de 1 mol/L mais celle en ions chlorure sera de 2 mol/L !
Solubilité
Les solides sont solubles dans des solvants de même nature, et les liquides sont miscibles s'ils ont la même nature.
Exemple :
- Dans chaque éprouvette ci-contre se trouvent de bas en haut trois solvants : CCl4 (apolaire), H2O (polaire) et C6H12 (apolaire). On voit que les solvant polaire et apolaire ne se mélangent pas.
- Éprouvette de gauche des cristaux de diiode I2(S) (apolaire) ont traversé les trois solvants : ils ne se sont dissous que dans les solvants apolaires.
- Éprouvette de droite des cristaux de sulfate de cuivre Cu(SO4)(S) (solide ionique) ont traversé les trois solvants : ils ne se sont dissous que dans l'eau, solvant polaire.

Extraction liquide-liquide
Un solide sera très souvent plus soluble dans un solvant que dans un autre. On peut utiliser cette propriété pour extraire un soluté d'un solvant.
Exemple :
L'arôme sont des molécules globalement apolaires. Pour en extraire certains qui ne supportent pas la distillation, on utilise l'enfleurage. Cela consiste à placer les fleurs (comme le jasmin par exemple) sur de la graisse (solvant apolaire). Les molécules aromatiques vont alors migrer du milieu aqueux (pétale) vers le milieu apolaire (graisse). On utilise aujourd'hui des techniques similaires avec des solvants plus volatils.

Propriété lavante des savons
Les molécules lavantes sont constituées de deux parties polaires et apolaires : on parle de molécules amphiphiles.
- Tête polaire (ou hydrophile) : c'est généralement une fonction carboxylate
- Queue apolaire (ou lipophile) : c'est généralement une longue chaîne carbonée
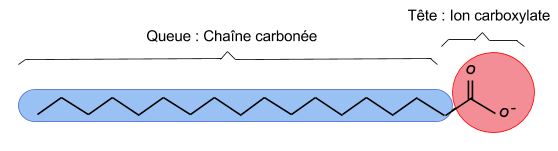
Pour enlever une tâche de gras, la queue apolaire du savon va se lier à la tâche (apolaire aussi) et les têtes polaires vont pouvoir être "emportées" par l'eau de lavage.

Exigibles du programme

