Utiliser le tableau d'avancement
On considèrera que toutes les réactions suivantes sont totales. On cherchera alors à déterminer pour chaque réaction la composition finale du milieu réactionnel.
Attention : on pensera à équilibrer les équations de réaction si nécessaire.
Combustion complète du carbone
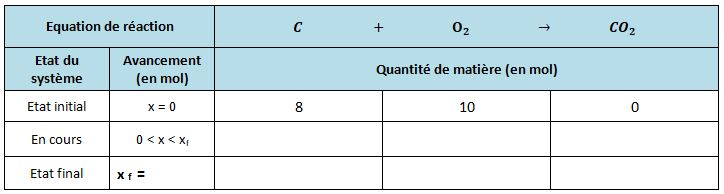
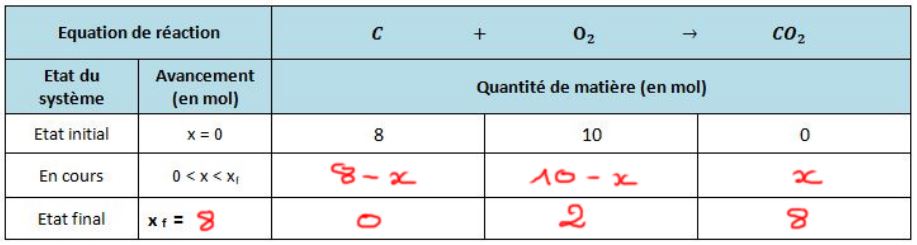
Une fois la ligne "en cours" remplie on cherche le réactif limitant.
Pour cela on calcule l'avancement maximal pour chaque réactif.
Ici le calcul est évident, on trouve un avancement maximal de 8 pour le carbone et 10 pour le dioxygène.
L'avancement final est le plus petit des avancements maximum calculés, donc ici 8 : le carbone est le réactif limitant et donc sera totalement consommé.
Combustion complète du butane
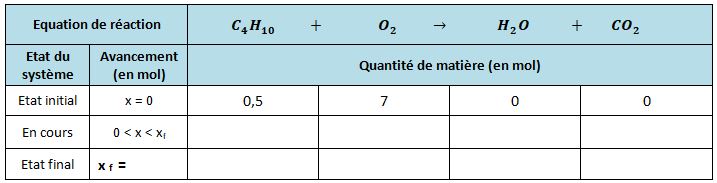
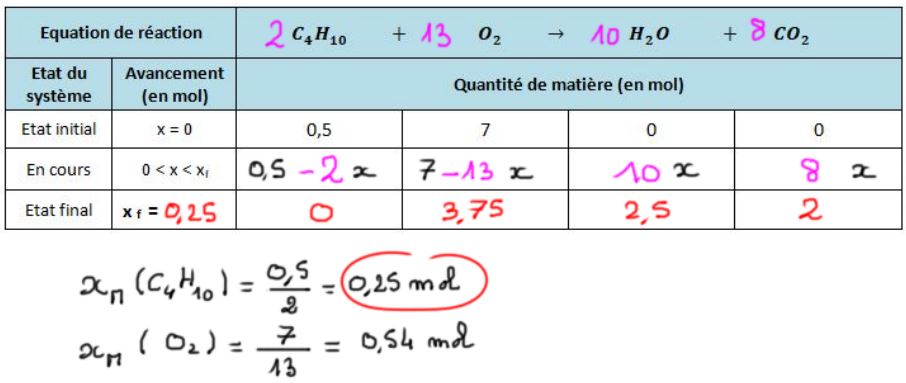
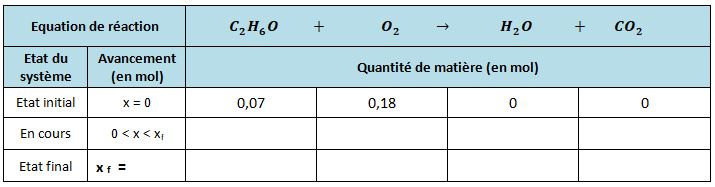
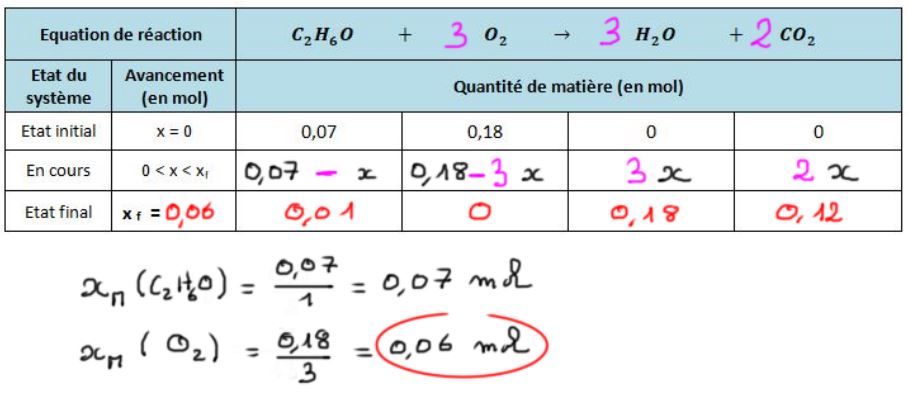
Combustion complète de l'éthanol
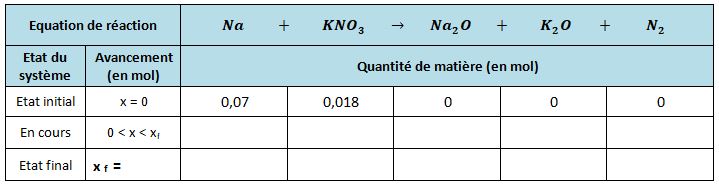
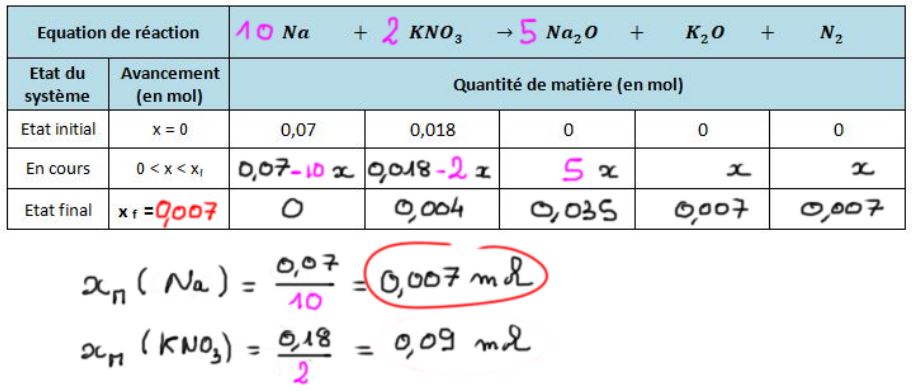
Chimie de l'airbag
Observer l'avancement
Une solution violette de permanganate de potassium est versée dans une solution incolore contenant des ions fer II. La seule espèce colorée du milieu réactionnel est l'ion permanganate MnO_4 ^-.
- Pourquoi peut-on dire qu'il y a une réaction chimique ?
- Quelle sera la couleur du milieu réactionnel si l'ion permanganate est le réactif limitant ?
Les couples redox mis en jeu sont MnO_4 ^-/Mn^{2+} ; et ; Fe^{3+}/Fe^{2+}. On verse 100mL de solution de permanganate de potassium de concentration 0,1 mol/L dans un bécher contenant 100mL de solution d'ions fer II ) la concentration de 0,1 mol/L.
- Ecrire l'équation bilan de la réaction
- Faire le tableau d'avancement et déterminer l'état final

Courbes d'avancement
La réaction des ions Al^{3+} avec les ions hydroxyde HO^-forme un précipité blanc d'hydroxyde d'aluminium Al(OH)_3.
Les deux graphes ci-contre montrent l'évolution des quantités de matière des réactifs pour deux mélanges initiaux différents.
La réaction est totale.
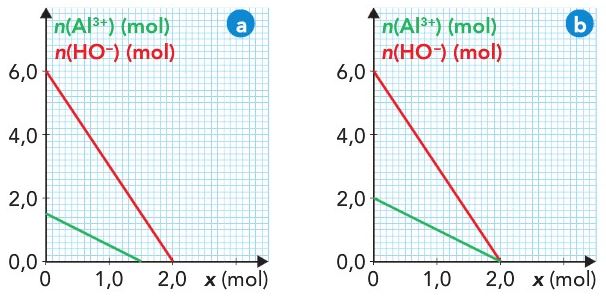
Pour chacune des deux situations indiquer :
- Les quantités de matières initiales de chaque réactif.
- L'avancement final de la réaction
- Le réactif limitant
Quel est le lien entre la pente de chaque courbe et l'équation de réaction ?
Résolution de problème : contrôle alcoolémie
Documents
Depuis le 22 mai 2020 les automobilistes ne sont plus obligés d'avoir dans leur voiture un éthylotest.
Il se présentait sous la forme d'un ballon dans lequel le conducteur devait expirer 1,0L d'air.
Cet air expiré était ensuite envoyé dans un tube contenant 2,5mg de cristaux oranges de dichromate de potassium.

Si de l'alcool est présent dans l'air expiré, il réagit alors avec les ions dichromate Cr_2O_7 ^{2-} qui se transforment alors en ions chrome Cr^{3+} de couleur verte.
L'éthanol C_2H_6O se transforme quant à lui en éthanal de formule C_2H_4O_2.
Données :
Masse molaire du dichromate de potassium : M1=294,0 g/mol
Masse molaire de l'éthanol : M2=46,0 g/mol
Problème
Le conducteur est "positif" lorsque la moitié des ions dichromate ont réagi.
Le taux d'alcoolémie sanguin, qui s'exprime en g/L, est égal à 2000 fois la concentration en masse de l'alcool dans l'air expiré.
Vérifier que lorsque le conducteur est dit "positif" il a bien un taux d'alcoolémie supérieur à la limite autorisée de 0,50g d'alcool par litre de sang.
