Pour les manipulations suivantes nous utiliserons une solution de diiode I2 (colorée rouge orangé) et une solution de thiosulfate de sodium (2 Na+ + S2O32−) incolore à la même concentration C=1,0.102−mol.L-1.
L'objectif est d'observer et déterminer l'avancement de la réaction.
Qualitativement
On verse progressivement 20mL de thiosulfate de sodium dans 5mL de diiode.
Au début le diode se décolore : on peut dire qu'il est le RÉACTIF LIMITANT, il est totalement consommée.
Plus tard le diode ne réagit plus, on peut dire que c'est le thiosulfate qui a totalement réagi et qui est devenu le RÉACTIF LIMITANT.
Quantitativement
- Ecrire l'équation de réaction
- Calculer les quantités initiales des deux réactifs
- Remplir le tableau d'avancement
- Déterminer le réactif limitant
- Justifier la couleur finale de la solution
1. Il s'agit ici d'une équation d'oxydo-réduction à équilibrer (voir chapitre oxydo-réduction)
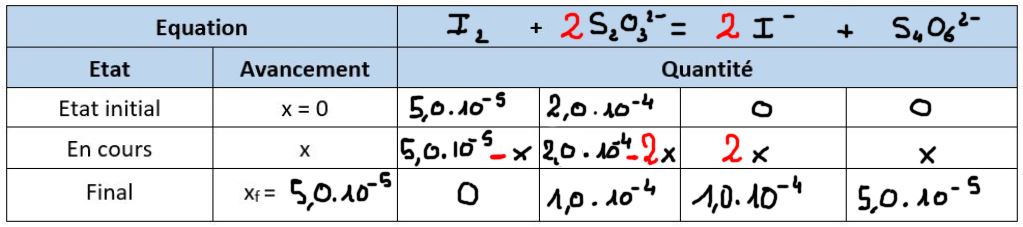
I2 + 2 S2O32− = S4O62− + 2 I−
2. On dispose des concentrations et des volumes des deux solutions donc on utilise l'expression n=C.V
On trouve :
n_i(I_2) = 1,0.10^{-2} times 5,0.10^{-3} = 5,0.10^{-5} mol
n_i(S_2O_3^{2-}) = 1,0.10^{-2} times 40,0.10^{-3} = 2,0.10^{-4}
3. On peut alors remplir le début du tableau d'avancement

4. Le réactif limitant sera le premier à voir totalement réagi. On calcule donc l'avancement maximal que permet chaque réactif, et c'est le plus petit qui déterminera le réactif limitant.
Ici x_{MAX}(I_2) = 5,0.10^{-5} mol : et : x_{MAX}(S_2O_3^{2-}) = 1,0.10^{-4} mol
Donc le plus petit avancement maximal est celui de I2 qui est le réactif limitant.
5. Le diiode ayant totalement réagi et les autres espèces étant incolores, la solution sera finalement incolore.
