Rappels de seconde

Une entité chimique n'existe que si elle a acquis sa forme la plus stable, donc celle qui permet à chaque atome la constituant d'avoir la structure du gaz rare le plus proche.
Rappels :
- Les électrons se répartissent sur des couches (1, 2, 3..) et des sous-couches (s et p au lycée).
- La structure la plus complète est donc celle de l'argon 18Ar : 1s2 2s2 2p6 3s2 3p6
- La dernière couche (ou couche de valence) est la seule qui nous intéresse en chimie car ce sont ses électrons qui pourront interagir avec les entités voisines. Pour qu'une entité existe dans la nature, cette couche devra être pleine.
Représentation de LEWIS
Règles de représentation
La représentation de Lewis permet de visualiser les électrons de la couche de valence :
- Point : représente un électron seul
- Trait : doublet électronique
- Rectangle : lacune électronique
Les atomes à connaître
On a vu en seconde que des atomes qui se trouvent dans une même colonne du tableau périodique ont la même structure de couche externe. On a donc tout intérêt à connaître la représentation de Lewis de la deuxième ligne du tableau (de plus ce seront des atomes que nous verrons très souvent en chimie)
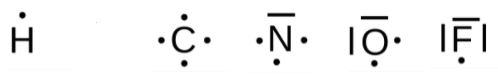
Des atomes aux ions
A l'exception de gaz rares (dernière colonne du tableau périodique), les atomes ont une couche de valence incomplète.
Ils peuvent donc se transformer en ions afin de se stabiliser, en gagnant ou en perdant des électrons.
Exemples : sodium 11Na et oxygène 8O
La dernière couche est notée en rouge
Entité | Structure électronique | Existe sous cet état dans la nature ? | Représentation de LEWIS |
|---|---|---|---|
Na (atome) | 1s2 2s2 2p6 3s1 | NON | |
Na+ (ion) | 1s2 2s2 2p6 | OUI | |
O (atome) | 1s2 2s2 2p4 | NON | |
O2- (ion) | 1s2 2s2 2p6 | OUI |
Géométrie des molécules et ions polyatomiques
Quand un atome (ci-contre en rouge) est lié a d'autres atomes, ces derniers se repoussent (interactions entre les électrons de la couche de valence). Pour cette raison ils vont se mettre le plus loin possible les uns des autres.
Connaître le nombre d'atomes voisins permet donc de prévoir la géométrie de la molécule.
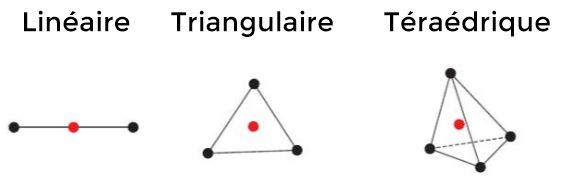

Les doublets non liants se comportent comme des atome du point de vue de la répulsion.
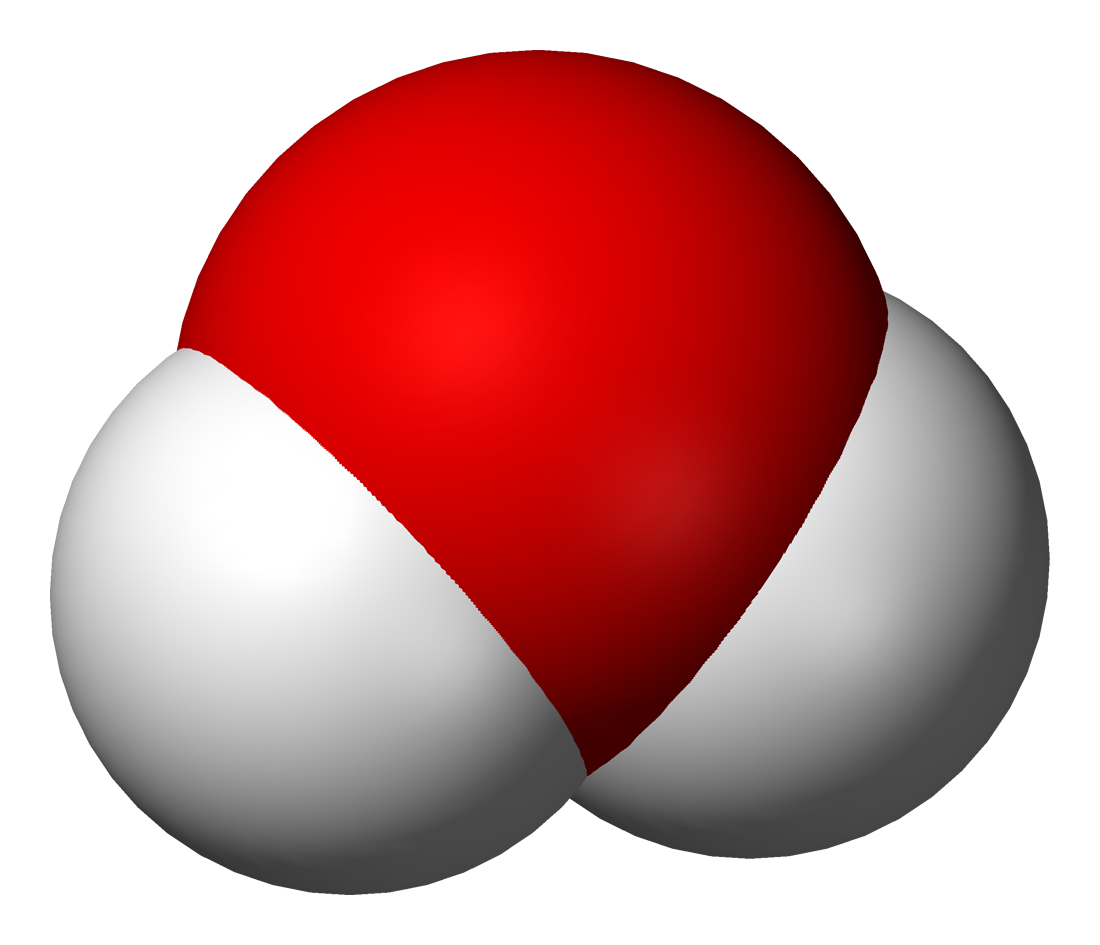
Dans la molécule d'eau par exemple, l'atome d'oxygène est lié à deux atomes d'hydrogène et possède 2 doublets non liants. Tout se passe comme s'il avait 4 voisins dont deux seront "invisibles".
La molécule d'eau est donc coudée.
Polarité d'un molécule
Electronégativité
Les éléments chimiques ont des électronégativités (aptitude à "attirer" les électrons) différentes.
On pourra retenir par ordre décroissant d'électronégativité les éléments qu'on rencontre le plus souvent :
F O N Cl Br I S C H
Polarité d'une liaison
Une liaison entre deux atomes est polarisée (déséquilibre électrique) si les atomes sont différents de part et d'autre de la liaison. L'atome le plus électronégatif attirera davantage les électrons du doublet liant vers lui, il "s'accapare" partiellement les électrons : on lui attribue une charge partielle δ-. L'autre atome aura lui "perdu" partiellement son électron, il aura une charge partielle δ+.
Polarité d'une molécule
Une molécule sera polaire si les centres géométriques des charges partielles positives et négatives ne sont pas confondus.
La molécule sera apolaire s'ils sont confondus.
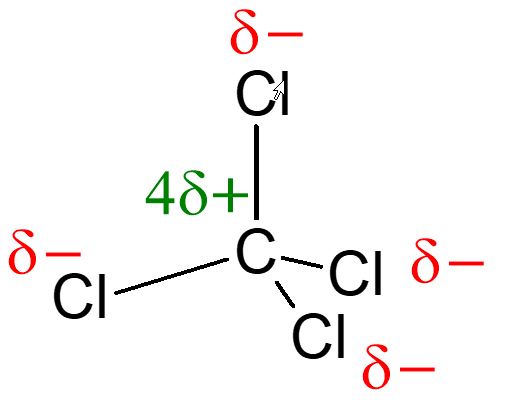
Dans le cas de CCl4 le centre des charges partielles positives et négatives se trouvent au centre de l'atome de carbone. La molécule CCl4 est apolaire.

Exigibles du programme

