La température
Définitions
La température est une grandeur physique qui traduit l'agitation des particules.
Pour un corps donné, elle est liée à l'état physique (état gazeux le plus agité, température élevée).

Elle se mesure en °C (degrés Celsius) ou K (Kelvin).
\boxed {\Large {T(K) = \theta (°C) + 273,15}}

Mesure de température
Les thermomètres doivent permettre de mesurer la température dans des situations très différentes. Pour cela un thermomètre sera souvent adapté à la plage de mesure.
- Thermomètre à dilatation de liquide : pour des température de l'ordre de quelques dizaines de degrés (ex : thermomètre à alcool)
- Thermomètre électriques : peut aller de températures négatives à quelques centaines de degré (ex : thermocouples, thermistances...)
- Pyromètres : pour des températures élevées (plus de 1000°C)
Les thermomètres peuvent utiliser le fait qu'un corps émet des radiations infrarouge en fonction de sa température. La gamme de mesure est alors très large
Modes de transfert thermique
Il existe trois modes de transfert thermique :
- Conduction : nécessite un contact
- Convection : par déplacement de matière
- Rayonnement : onde électromagnétique pouvant se propager dans le vide (lumière)

Énergie interne
L'énergie interne d'un système est l'énergie qu'il possède du point de vue microscopique (essentiellement dû à l'agitation thermique).
Si on change la température du système son énergie va varier.
Chaque corps possède une capacité thermique massique "c" qui lui est propre (qui traduit l'énergie nécessaire pour faire gagner 1K à 1kg de ce corps).
On note Q l'énergie reçue par le système :
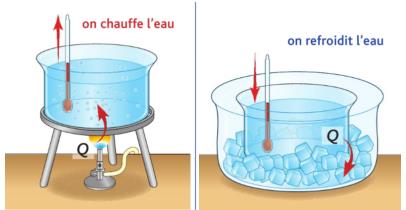
\boxed {\Large {Q = m \times c \times (T_f - T_i)}}

Q en J
m en kg
c en J.kg-1.K-1
T en K
Remarque : Si la température finale est supérieure à la température initiale alors Q est positif ce qui veut dire que le système a reçu de l'énergie.
Exemple : Combien faut-il d'énergie pour passer 500g d'eau de 10°C à 90°C ?
Donnée : c_{eau}=4180 J.K^{-1}.kg^{-1}
Q = m \times c \times (T_f - T_i)=0,500 \times 4180 \times (90-10) = 167 kJ
Énergie massique de changement d'état
Pour changer d'état un corps doit céder ou gagner de l'énergie, mais il le fait à température constante (voir courbe de solidification de l'eau ci-contre).
Lors d'une fusion ou d'une vaporisation il doit en gagner, lors d'une liquéfaction ou d'une solidification il doit en perdre.
L'énergie massique de changement d'état "L" est l'énergie nécessaire pour que 1 kg de ce corps change d'état.
Lors qu'un changement d'état on peut donc calculer l'énergie reçue (ou cédée) par le système :

\boxed {\Large {Q = m \times L}}

Q en J
m en kg
L en J.kg-1
Exemple : Combien faut-il d'énergie pour faire fondre 500g de glace ?
Donnée : L_{fusion \, de \, la \, glace} = 333 \, kJ.kg^{-1}
Q = m \times L_{fusion \, de \, la \, glace} = 0,500 \times 333 = 167 kJ
Remarque : il faut autant d'énergie pour faire fondre un morceau de glace que pour élever la même masse d'eau de 80°C ! Les changements d'état sont très énergivores...

