Aspect microscopique
Lorsqu'un corps change d'état les liaisons entre atomes (ou molécules) s'affaiblissent ou se renforcent.
Dans le cas de l'eau, ces liaisons entre molécules sont appelées liaisons hydrogène et relient un atome H d'une molécule à un atome O d'une molécule voisine.

Diagramme d'état
Un diagramme d'état est un graphique permettant de déterminer l'état dans lequel se trouve un corps pur pour une température et une pression donnée. Ce diagramme représente la température en abscisses et la pression en ordonnées.

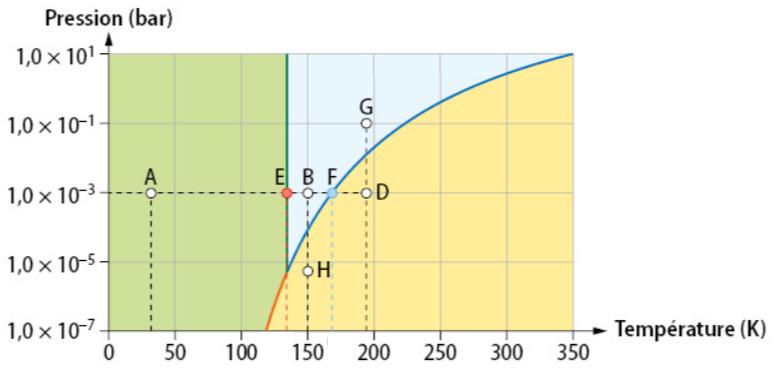
Dans chacune des trois régions le corps se trouve sous un seul état :
- Au point E (20 K ; 0,01 bar) l'eau est solide
- Au point F (500K ; 1000 bar) l'eau est liquide
Sur chacune des trois frontières le corps se trouve sous deux états :
- Au point D (270 K ; 0,01 bar) l'eau est solide ET liquide
- Au point B (560K ; 100 bar) l'eau est liquide ET gaz
Au point triple (croisement des frontières) l'eau est dans les trois états à la fois.
Au-delà du point C l'eau est à l'état supercritique, c'est-à-dire qu'elle a un comportement intermédiaire entre un liquide et un gaz.
Changement d'état
On peut changer l'état d'un corps de plusieurs façons :
- En modifiant la température : A → B (fusion)
- En modifiant la pression : H → B (liquéfaction)
- En modifiant la température et la pression : G → H (vaporisation)
Lors du changement d'état, le corps doit recevoir (ou céder) de l'énergie. Chaque changement d'état nécessite sa propre énergie massique.
Diagramme (P,T) du butane
Exemples : cas de l'eau
- énergie massique de vaporisation : 2 260 J/g
- énergie massique de fusion : 330 J/g
On voit que la fusion demande moins d'énergie que la vaporisation. Autrement dit, il est plus facile de faire fondre 1kg de glace que de faire s'évaporer 1 kg d'eau.
Remarque : cas de l'eau
Pour rappel il faut 4,18 J pour élever de 1°C 1g d'eau alors qu'il faut 330J pour faire fondre 1g de glace...
